L’identification des maladies est réalisée d’après la classification de l’encyclopédie Orphanet. Le code ORPHA est un identifiant unique, stable dans le temps, associé à chaque entité de la classification Orphanet des maladies rares. Ces entités peuvent être des groupes de maladies, des maladies ou des sous-types de maladies. Les numéros ORPHA sont destinés, entre autres, à être inclus dans les systèmes d'information en santé afin de permettre l'identification des patients ayant une maladie rare, qu'elle soit génétique ou pas.
Le numéro ORPHA désigne des entités cliniques qui peuvent être associées à un ou plusieurs gènes. Ainsi peuvent être comptabilisées comme deux pathologies distinctes deux formes d’une même maladie enregistrées sous deux numéros ORPHA différents. Chaque numéro ORPHA peut correspondre à un ou plusieurs numéros OMIM également utilisés par les laboratoires.
La génétique moléculaire est guidée par une succession d’évolutions technologiques avec l’utilisation du séquençage de nouvelle génération (NGS). En pratique, pour de très nombreuses maladies pouvant impliquer plusieurs gènes, ou pour les pathologies qui partagent une « porte d’entrée » clinique identique, les laboratoires testaient les gènes les uns après les autres avant l’arrivée de cette technologie. Avec le séquençage massif parallèle (technologie NGS), les laboratoires ont pu développer des panels. Un panel est un ensemble de gènes testés pour une indication. Ainsi, lorsqu’un prélèvement nécessite plusieurs examens différents afin de poser un diagnostic, il devient possible de les réaliser en une seule analyse. En pratique, pour un individu, avant le NGS, le nombre d’examens comptabilisés correspondait à la somme des gènes testés. Avec les panels, le nombre d’examens comptabilisés est égal à un par patient quel que soit le nombre de gènes inclus dans le panel.
En plus des panels, certains laboratoires proposent le séquençage d’exome, voire, dans le cadre du plan France Médecine Génomique, le séquençage du génome. L’examen de l’exome est l’analyse de l’ensemble (ou presque) des exons de tous (ou presque) les gènes d’un individu. Le séquençage du génome est le séquençage de l’ensemble (ou presque) du patrimoine génétique de la personne.
L’Agence de la biomédecine fait donc régulièrement évoluer le rapport d’activité afin de rendre le plus compte de la réalité de la pratique.
Dans la suite du rapport seront distinguées d’une part, les activités en lien avec le diagnostic de maladies, et d’autre part, les activités en lien avec la pharmacogénétique.
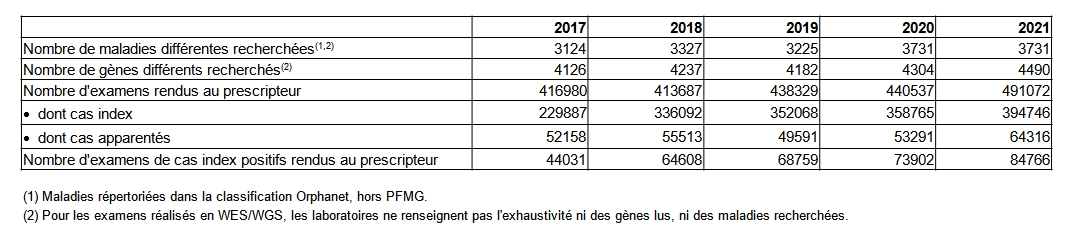
En 2021, 465 589 personnes ont bénéficié d’un examen de génétique moléculaire, qu’il s’agisse de cas index (personne symptomatique chez qui est réalisé le diagnostic) ou d’apparentés. Plusieurs examens peuvent être réalisés pour une même personne. Le nombre total d’examens réalisés en génétique moléculaire a été de 491 072 en 2021 soit +15% d’augmentation en 5 ans. Le volume d’examen déclaré, si l’on fait exception de l’année 2020 ces chiffres sont en augmentation ces cinq dernières années. De même le nombre de gènes différents analysés par les laboratoires est passé de 4 126 à 4 490 soit plus 9% en cinq ans (Tableau POSTNATAL15)
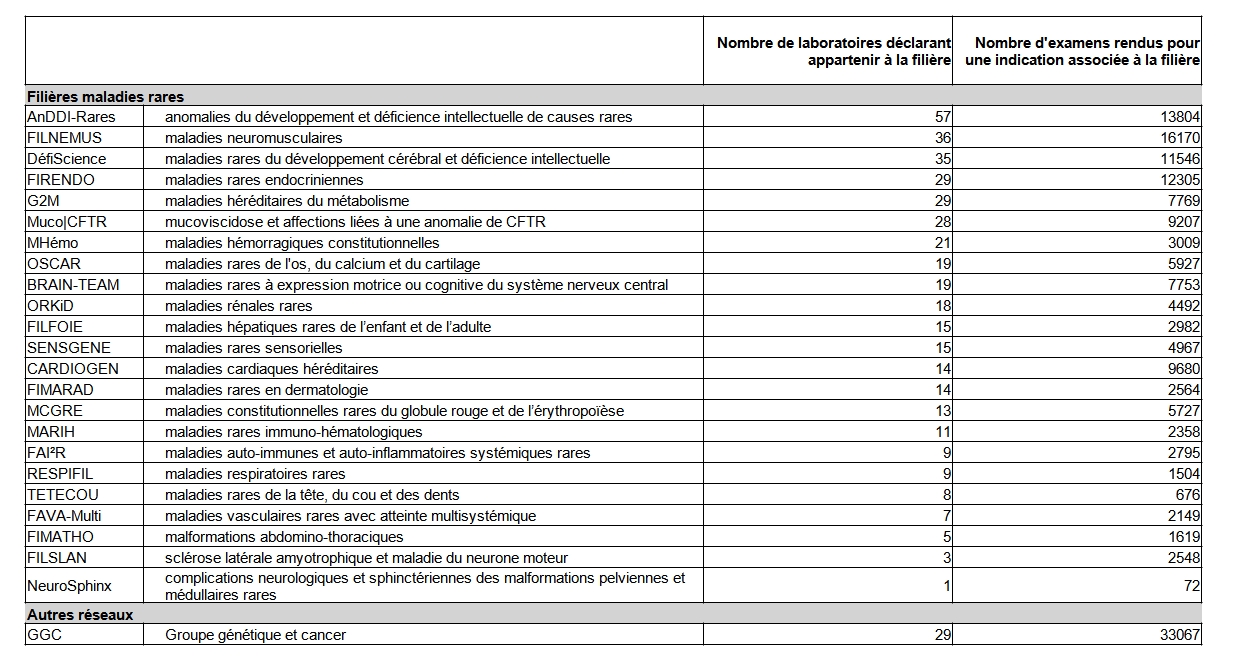
Parmi les laboratoires, 115 déclarent travailler en lien avec au moins une filière de santé maladies rares du plan national maladies rares (Tableau POSTNATAL14). Un même laboratoire peut travailler avec plusieurs filières.
(1) Maladies répertoriées dans la classification Orphanet, hors PFMG et hors WES/WGS.
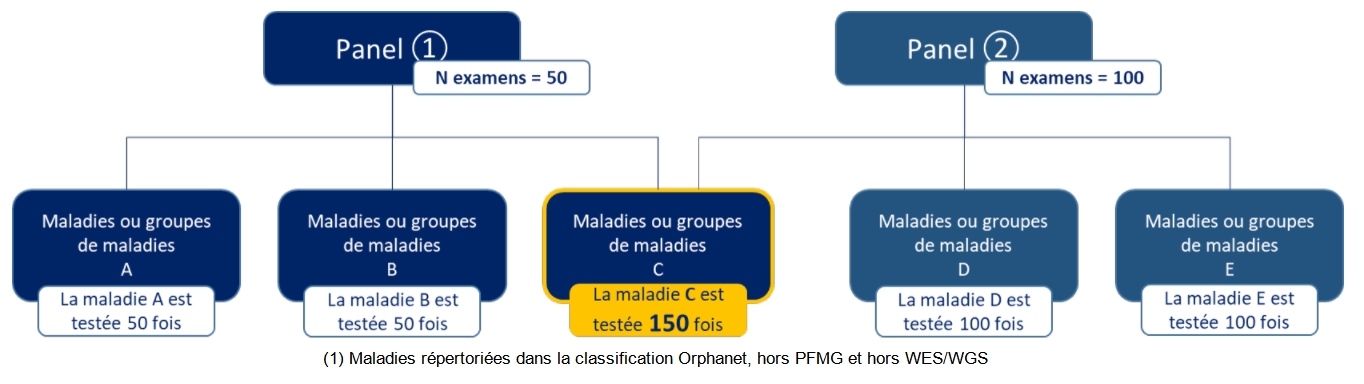
L’illustration POSTNATAL5 schématise la manière dont sont comptés et présentés les examens. Le nombre total d’examens réalisés est égal à la somme du nombre d’examens réalisés pour chaque panel. Dans l’exemple ci-dessus, le nombre total d’examens égale Panel 1 + Panel 2 = 50 + 100. Au total 150 examens ont été réalisés. L’analyse par maladie (ou groupe de maladies) est basée sur le n° ORPHA. Le nombre de fois où une maladie (ou groupe de maladies) a été testée est égal à la somme du nombre d’examens pour des panels dans lesquels elle est représentée. Dans l’exemple ci-dessus : la maladie C est testée dans les panels 1 et 2, elle aura été testée 150 fois. La maladie A est testée uniquement dans le panel 1, elle aura été testée 50 fois.
Ainsi le nombre total d’examens réalisés (491 072) n’est pas égal à la somme du nombre de fois où des maladies ont été testées (4 434 909). C’est la force des panels que de pouvoir tester plusieurs gènes et donc de rechercher plusieurs pathologies en un seul examen. L’utilité de cette démarche réside en l’augmentation des chances de poser un diagnostic à partir de signes cliniques parfois non spécifiques.
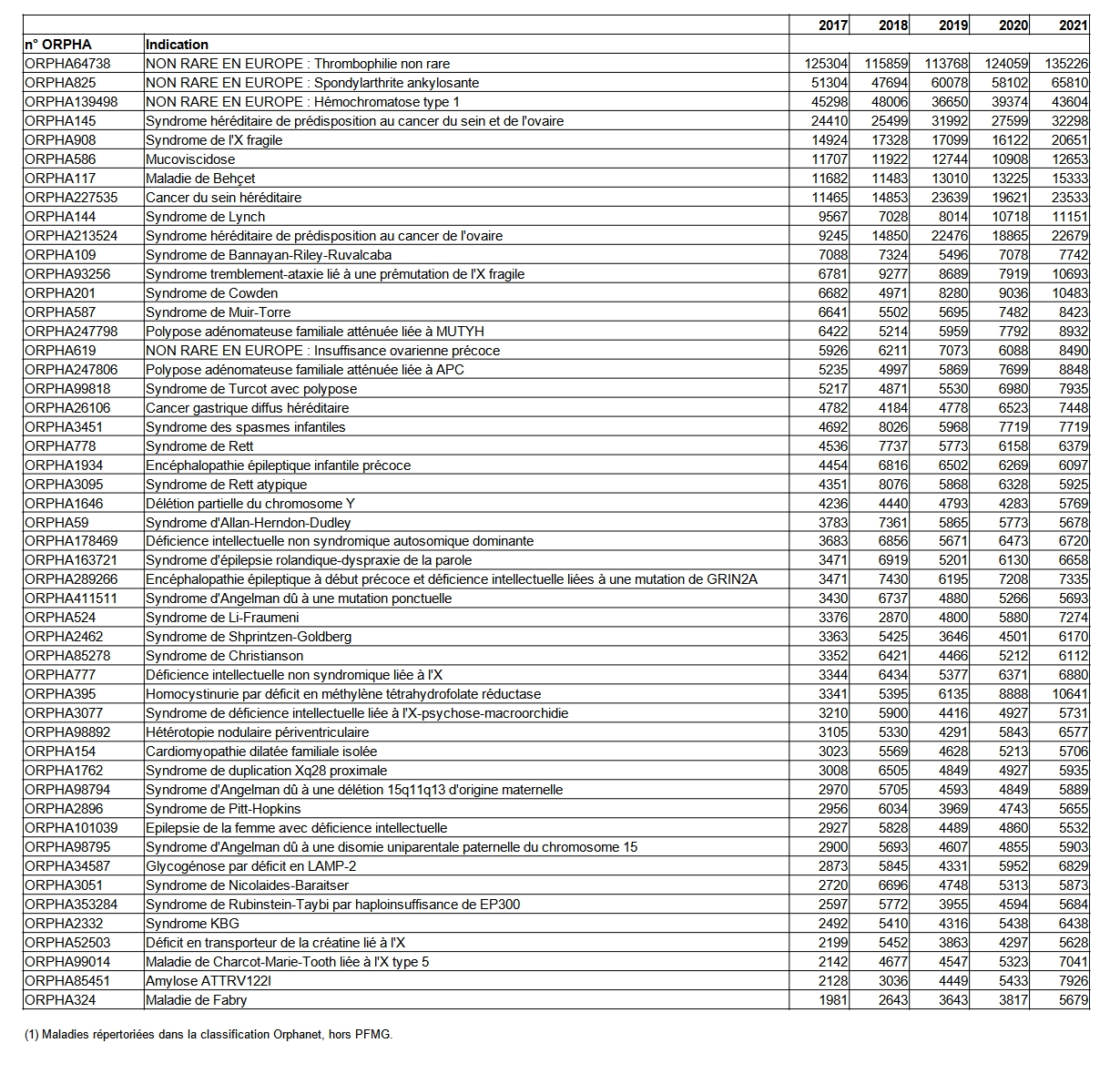
A noter que les examens pour l’hémochromatose de type 1 et la thrombophilie non rare restent très prescrits et réalisés (Tableau POSTNATAL16). Il s’agit des 2 seuls examens de génétique moléculaire répertoriés dans la nomenclature des actes de biologie médicale. Si en volume, ces deux tests sont importants, leur réalisation est peu couteuse et peu chronophage (variations génétiques ciblées) par rapport à l’analyse plus complexe et exhaustive de la séquence des autres gènes. Le nombre de laboratoires qui proposent ce dernier type d’examen augmente régulièrement. La liste des 50 examens les plus réalisés en France (Tableau POSTNATAL16) montre la présence de plusieurs maladies pour lesquelles les gènes impliqués sont des gènes de susceptibilité. En 2021, 89 054 individus ont eu un examen génétique portant sur le HLA dans le cadre de susceptibilité à des maladies. Il est important de rappeler ici l’arrêté du 27 mai 2013 définissant les règles de bonnes pratiques applicables à l’examen des caractéristiques génétiques d’une personne à des fins médicales qui précise que : « Les examens de génétique ne doivent être prescrits que lorsqu’ils ont une utilité clinique et qu’ils sont souhaités par la personne. Le seul fait qu’un examen soit disponible et réalisable ne justifie ni de sa prescription ni de sa réalisation » et que « de nombreux variants génétiques (polymorphismes) sont actuellement identifiés comme ne contribuant à modifier que faiblement un risque de maladie. Le risque de développer la maladie est bien inférieur à celui de la prédisposition. L’anomalie génétique n’est ni nécessaire ni suffisante pour développer la maladie ».
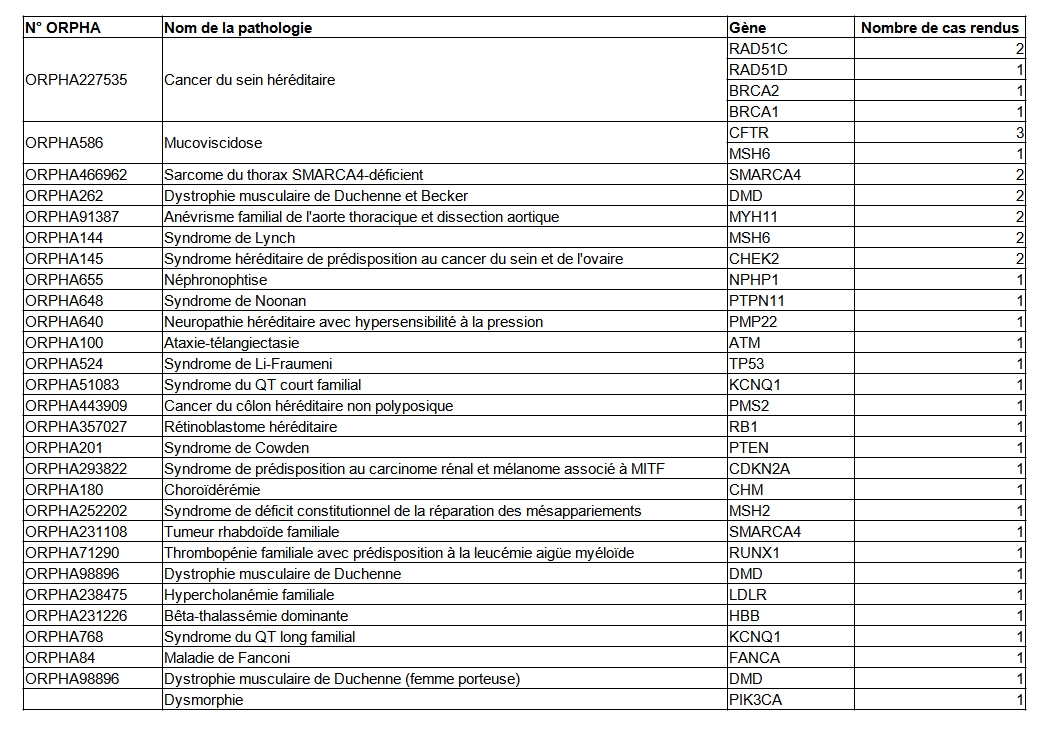
Le système de recueil actuel ne permet pas de discriminer clairement les examens réalisés pour des indications précises. A titre d’exemple le syndrome héréditaire de prédisposition au cancer du sein et de l'ovaire (ORPHA145), le cancer du sein héréditaire (ORPHA227535) ou le syndrome héréditaire de prédisposition au cancer de l'ovaire (ORPHA213524) sont peut-être comptabilisés trois fois pour un même examen pour certains laboratoires ou comptabilisés une seule fois pour d’autres.
Une refonte complète du dispositif de recueil est en train d’être mis en place avec l’appui des sociétés savantes de génétique afin d’améliorer la qualité de l’information recueillie.
L’ensemble des examens par code ORPHA est disponible dans le tableau POSTNATAL17 et par gènes dans le tableau POSTNATAL18.
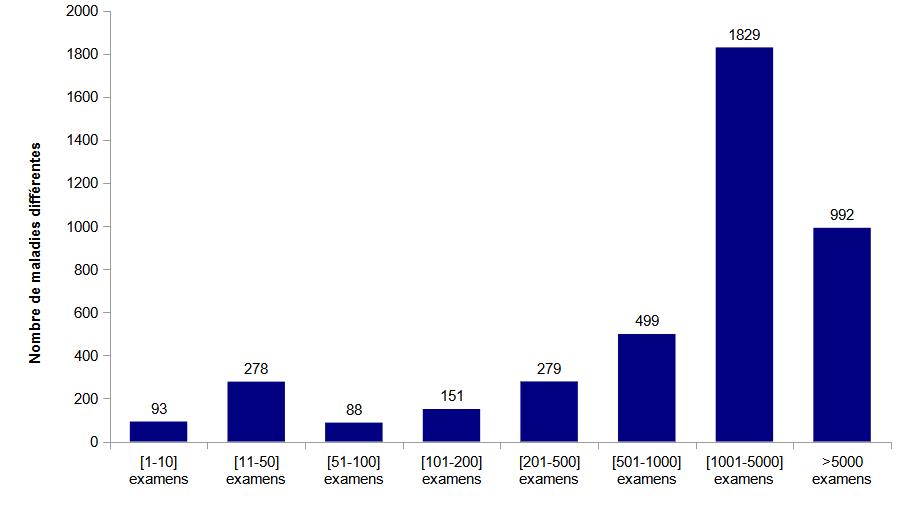
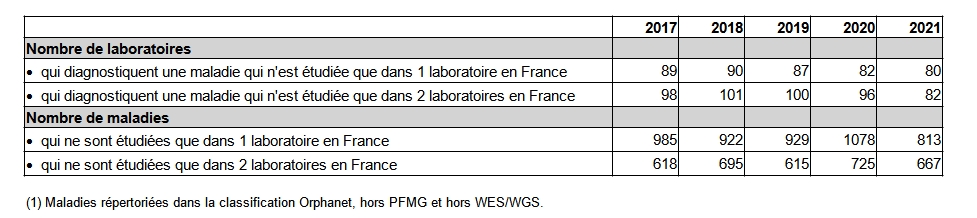
Les maladies génétiques sont très majoritairement rares, voire très rares. Développer des examens diagnostiques pour ces dernières peut se révéler très complexe. Ainsi, les laboratoires se sont généralement spécialisés : 80 laboratoires sont seuls à proposer le diagnostic d’une maladie pour toute la France et 813 maladies (28 %) ne sont diagnostiquées que dans un seul laboratoire (Tableau POSTNATAL19). Une attention particulière doit être portée à la nécessité de garantir une qualité d’expertise pour l’interprétation des examens. Celle-ci passe encore par le maintien de l’exercice en réseau des laboratoires qui individuellement ne pourront pas développer l’expertise nécessaire à l’interprétation des résultats obtenus notamment sur l’ensemble d’un génome.
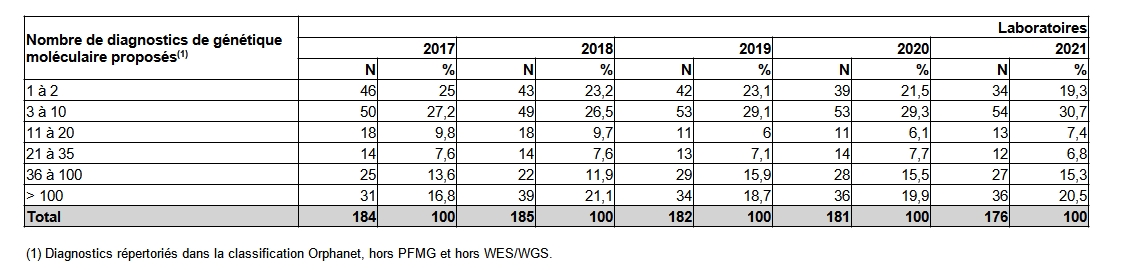
Les laboratoires français réalisent entre 1 et plus de 1000 diagnostics de maladies différentes. Néanmoins, 19,3% des laboratoires ne proposent qu’un ou deux diagnostics de maladies différentes (Tableau POSTNATAL21).
Par ailleurs, 413 prélèvements ont été envoyés à l’étranger par des laboratoires autorisés pour les examens des caractéristiques génétiques. Les maladies génétiques pouvant être extrêmement rares, certains examens ne sont pas proposés en France afin de garantir l’expertise d’interprétation. Au regard du nombre total d’examens réalisés en France, la part envoyée à l’étranger reste exceptionnelle.
La figure POSTNATAL5 montre la répartition des indications par nombre d’examens pratiqués et illustre notamment la rareté de la majorité des maladies génétiques.
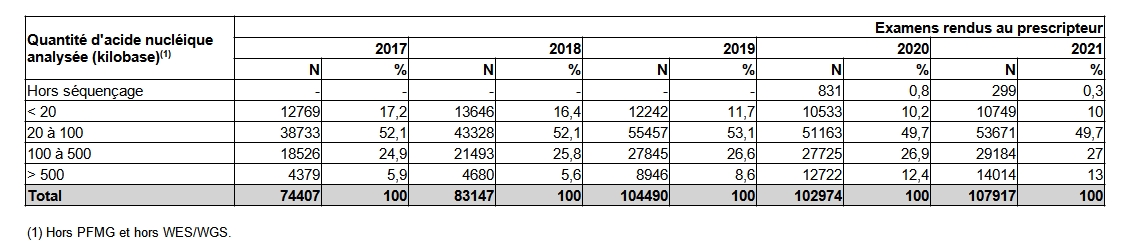
Le tableau POSTNATAL22 décrit la répartition des examens en fonction de la taille totale (exprimée en kb) des segments génomiques analysés. L’intérêt de cette donnée consiste principalement au suivi de la taille des panels. C’est par ailleurs l’unité de mesure choisie pour les examens réalisés par NGS dans le RIHN (Référentiel des actes Innovants Hors Nomenclature).
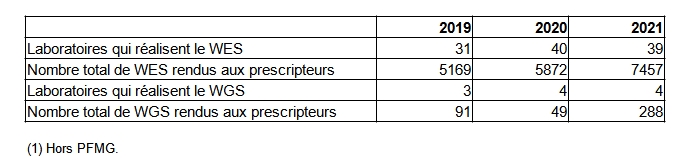
Outre les panels, le séquençage d’exome et le séquençage de génome se sont développés dans le même objectif de limitation de l’errance diagnostique. En 2021, 39 laboratoires ont fourni 7 457 comptes rendus d’examen de l’exome au prescripteur soit 44,3% de dossiers en plus qu’en 2019. Par ailleurs, quatre laboratoires (hors déclaration des laboratoires des plateformes Sequoia et Auragen du Plan France médecine génomique 2025) ont rendu 288 résultats d’examen de génome entier aux prescripteurs soit trois fois plus qu’en 2019 (Tableau POSTNATAL23).
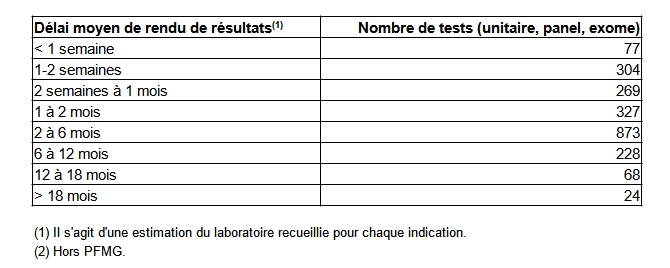
Le délai moyen de rendu d'un examen au prescripteur est décrit dans le tableau POSTNATAL24. Les différences de délais peuvent s’expliquer en partie par la nature variable des examens allant de l’utilisation de trousses commerciales testant 2 variants (exemple des facteurs II et V de la coagulation) à des panels de plus de 100 gènes, voire des exomes. Néanmoins une analyse plus fine sera nécessaire et réalisée avec les professionnels de la génétique afin de mieux interpréter les délais de rendu.
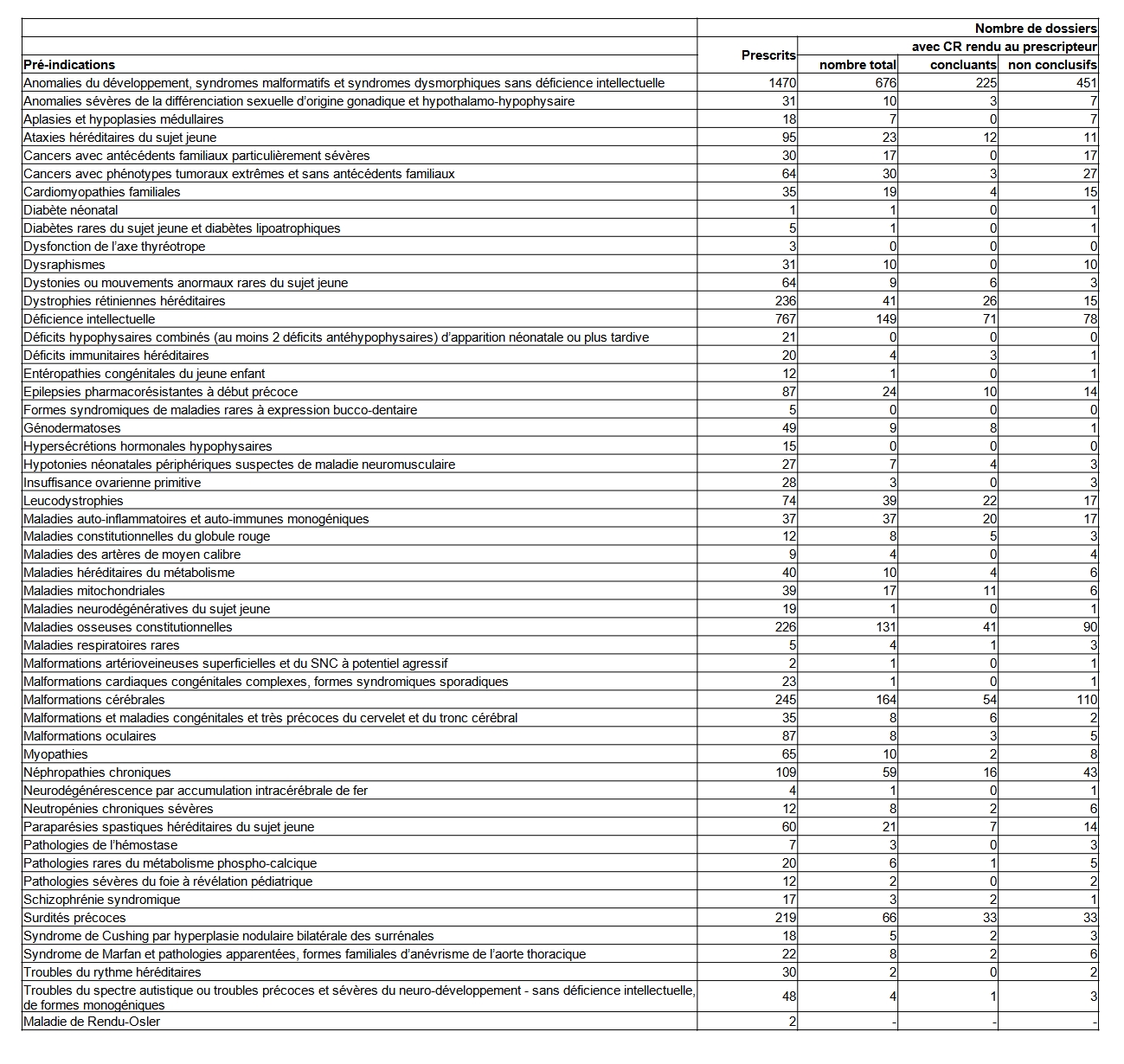
Dans le cadre du Plan France Médecine Génomique 2025, deux laboratoire de séquençage très haut débit, ont été autorisés. Des pré-indications ont été définies par la Haute Autorité de Santé. Des premiers prélèvements ont été reçus par les plateformes en fin d’année 2019. Les premiers résultats ont été obtenus en 2020 et l’activité a pris un réel essor en 2021. Ils sont présentés dans le tableau POSTNATAL25.
Avec l’utilisation de plus en plus importante d’examens pangénomiques, l’Agence de la biomédecine a mis en place le recueil d’information relatif aux données incidentes (tableaux POSTNATAL26 et POSTNATAL27). On entend par donnée incidente une variation pathogène, sans relation directe avec l’indication initiale ayant conduit à la prescription de l’examen, et de découverte fortuite. En 2021, 35 variations incidentes ont été déclarées dans le cadre du rapport annuel à l’Agence de la biomédecine (un résultat n’a pas été précisé). Les techniques qui ont conduit à la mise en évidence de ces variations ont été les panels de gènes, l’ACPA. Aucun examen du génome entier n’a fait l’objet de déclaration de données incidentes en 2021. La nouvelle loi relative à la bioéthique, en introduisant la notion de données incidentes, va permettre de clarifier ces situations lorsque les textes d’application seront publiés. Cette donnée (probablement sous-évaluée) va très probablement évoluer dans les prochaines années en raison des modifications des technologies employées dans le but de limiter l’errance diagnostique. Une attention particulière sera portée par l’Agence de la biomédecine sur le suivi de cette donnée.


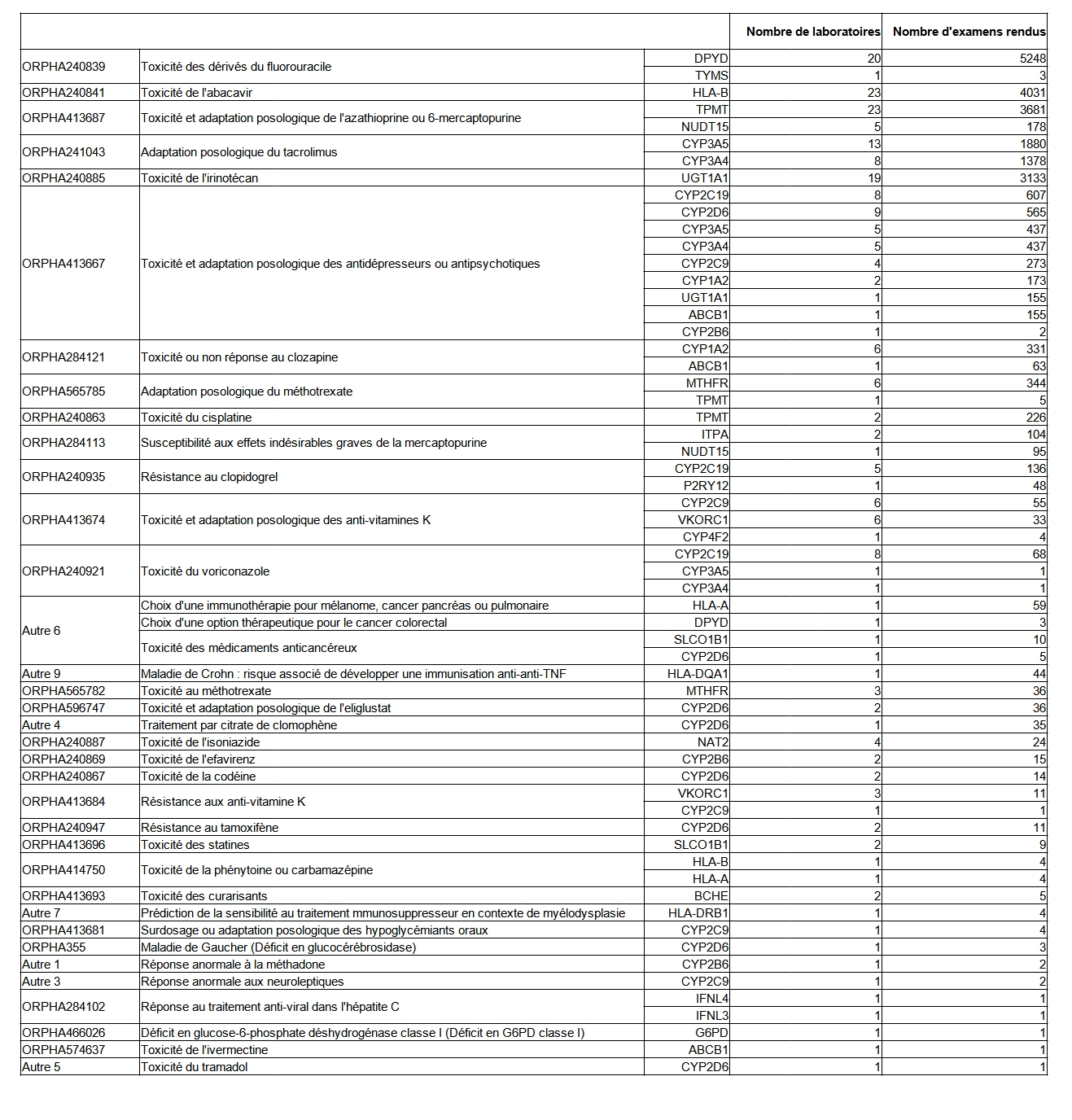
La pharmacogénétique est l’étude du lien entre certaines caractéristiques génétiques constitutionnelles d’un individu et la réponse de l’organisme à un ou plusieurs médicaments. La prescription des examens de pharmacogénétique dépend donc étroitement de la prescription de certains médicaments et de l’évolution des traitements. En 2021 18 966 individus ont bénéficié d’un examen de pharmacogénétique. Le nombre d’examens en 2021 révèle une diminution par rapport à celui de 2020, diminution portant essentiellement sur la prescription relative aux dérivés du fluorouracile (Tableau POSTNATAL28). La liste des gènes testés en lien avec les effets médicamenteux est présentée tableau POSTNATAL29.